Influence de la microgravité sur le processus de développement embryonnaire des mammifères examinée à la Station spatiale internationale
Les embryons de mammifères, lors de leur différenciation en masse cellulaire interne (ICM) et en trophoblaste au stade cellulaire 8-16, forment normalement un seul groupe qui évolue en un seul fœtus. Cette étude examine l’impact de la microgravité sur ce processus. Des embryons de souris congelés ont été décongelés et cultivés en microgravité à la Station spatiale internationale pendant quatre jours. Les résultats montrent que les embryons cultivés en microgravité atteignent le stade de blastocyste avec des caractéristiques similaires à ceux cultivés sous une force gravitationnelle artificielle de 1 g, démontrant ainsi que la gravité n’a pas d’effet significatif sur la formation de blastocystes et la différenciation initiale des embryons de mammifères.
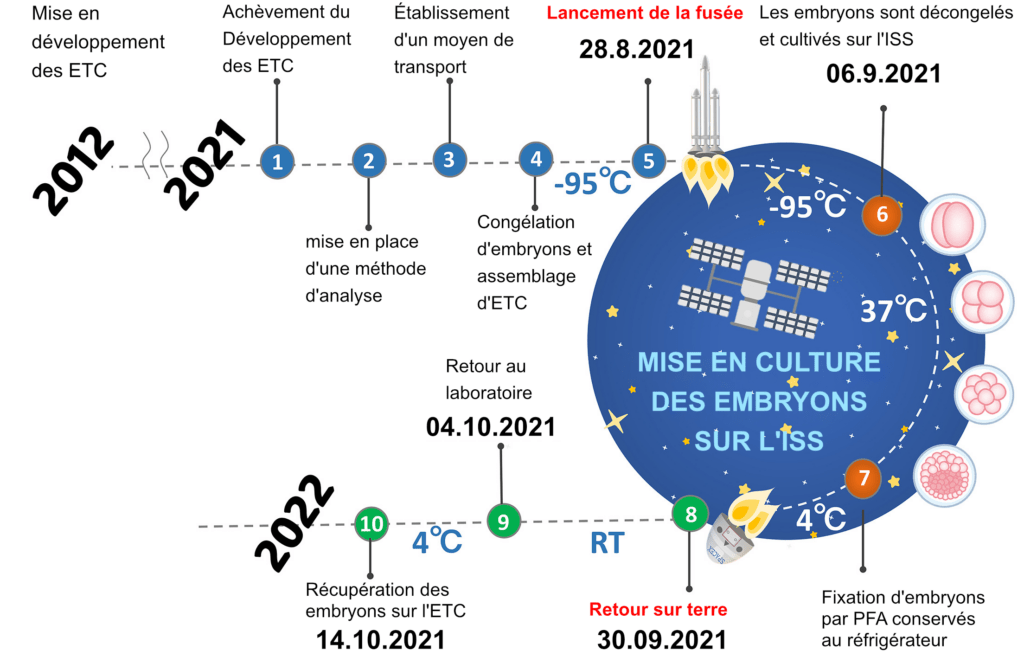
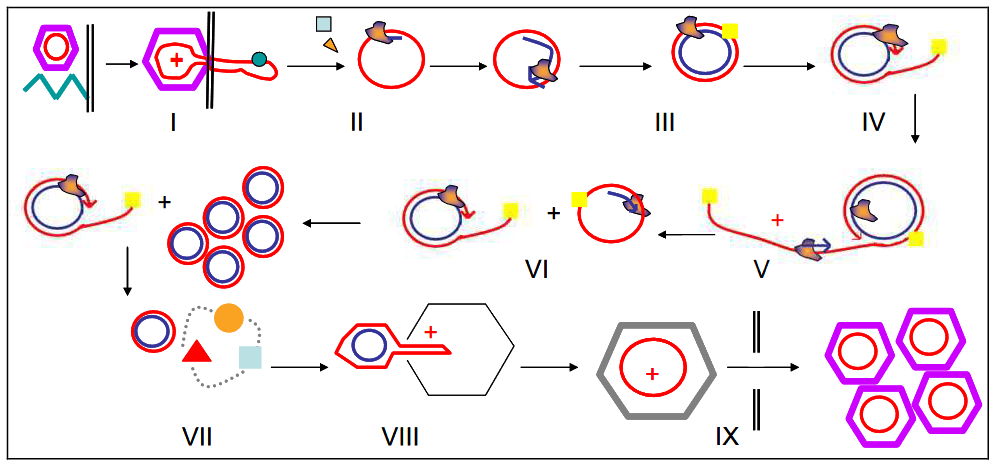
/// Schéma montrant le calendrier de ce projet. Les dates sont indiquées lorsque l’embryon congelé a été préparé, déjeuné à l’ISS, décongelé et cultivé sur l’ISS, fixé avec la PFA, retourné sur Terre, et les blastocystes ont été analysés ///
Introduction
L’élucidation de l’effet des conditions spatiales, telles que la microgravité et le rayonnement, sur la reproduction des mammifères est essentielle pour assurer la survie à long terme de l’homme dans l’espace. Bien que quelques études aient été menées sur les effets du rayonnement spatial sur les spermatozoes de mammifères, l’impact de la microgravité sur le développement embryonnaire n’a été signalé que chez les oursins, les poissons et les amphibiens. La reproduction des mammifères est compliquée et très spécialisée et est différente de celle des autres taxons. La fécondation et l’implantation se produisent dans l’utérus, et la mère soutient la croissance fœtale à travers le placenta jusqu’au développement fœtal à terme. Ainsi, les résultats de recherche d’espèces non-mammifères ne peuvent pas être extrapolés pour comprendre la reproduction des mammifères dans l’espace.
Dans les embryons de mammifères préimplantants, après la spécification du devenir de la première cellule, le blastocyste se développe en deux types de cellules: la couche externe de trophectoderm (TE) et la masse cellulaire interne (ICM). La couche cellulaire TE exprime Cdx2 et contribue à la formation du placenta, et la cellule ICM exprime des facteurs de transcription tels que Oct4 et Nanog, qui contribuent à la formation du fœtus. Le premier destin cellulaire a été contrôlé par la position extérieure intérieure des blastomères, et on ne sait pas comment cette position est contrôlée. Lorsque les embryons se développent en blastocystes, les cellules ICM se regroupent toujours à un endroit de la cavité blastocyste, suggérant que les cellules ICM sont plus lourdes que les autres cellules et s’enfoncent au fond de la cavité de blastocyste.
Si la gravité est la cause du positionnement extérieur à l’intérieur des cellules et la collecte de cellules ICM en un seul endroit, il peut ne pas être possible pour les cellules de se différencier correctement en cellules ICM et TE ou pour les cellules ICM de se rassembler en un endroit de la cavité de blastocyste dans l’espace. Si les cellules ICM sont accidentellement divisées en deux dans la cavité du blastocyste, naissent des jumeaux monozygotes identiques partageant un placenta, ce qui peut entraîner une charge accrue pour les fœtus ainsi que la mère avec un risque accru de fausse couche, en particulier chez les espèces à gestetation unique. Ainsi, si la gravité affecte la différenciation et la localisation cellulaires dans les embryons de mammifères, les humains seraient incapables de se reproduire dans l’espace.
Ici, nous avons cherché à déterminer si les mammifères sont capables de se reproduire normalement dans l’espace, où il y a une gravité à peu près nulle. Bien que les souris et les rats devraient être utilisés pour des expériences de reproduction dans l’espace, il est actuellement impossible de les conserver dans la Station spatiale internationale (SISS) pendant une longue période. En outre, les expériences de reproduction sur les mammifères ont des critères particuliers. Par exemple, le changement de la salle d’élevage modifie le cycle esttreur, ce qui peut conduire à l’échec de l’agricolement.
Au lieu de mener une véritable expérience spatiale, notre groupe a déjà mené une expérience sur le développement embryonnaire de mammifère in vitro dans des conditions simulées et g à l’aide d’un clinostat tridimensionnel. Les embryons cultivés pendant 4 jours sous – g ont présenté des anomalies significatives, telles que le développement embryonnaire retardé, la détérioration du trophétoderme, des taux de différenciation altérés et une réduction significative des taux de natalité après transfert à une fille. Des résultats similaires ont également été rapportés par d’autres laboratoires. Lorsque des embryons au début ont été cultivés dans des conditions de microgravité simulées, beaucoup d’embryons sont morts de 72 h, ou une diminution du nombre d’embryons atteignant les stades du blastocyste a été observée après 96 h. Ainsi, bien que l’impact sur les embryons ait quelque peu varié en fonction du type de simulateur de microgravité, les effets néfastes sur le développement de l’embryon ne se sont produits que dans ceux cultivés sous l’état de microgravité simulé.
Pour évaluer en profondeur l’impact réel de l’espace, les embryons congelés devraient être transportés, décongelés et cultivés par des expérimentateurs hautement qualifiés plutôt que de compter sur les astronautes à l’ISS (parce que les embryons sont très petits; 80 à 100 pm); cependant, ce n’est pas pratique. Nous avons conçu plusieurs méthodes et outils pour réaliser ces expériences, comme un simple dispositif de décongélation et de culture d’embryons congelés sur l’ISS. et a identifié la phase appropriée d’embryons de souris à deux cellules et le milieu de culture approprié pour ce projet. Nos résultats permettront au personnel non formé sur Terre et aux astronautes de l’ISS de réaliser des expériences embryonnaires. À l’aide de cette méthode, des embryons surgelés à 2 cellules ont été lancés à l’ISS, décongelés par des astronautes, cultivés sur l’ISS pendant 4 jours, et utilisés pour déterminer si les embryons de mammifères peuvent se développer en blastocystes normaux dans les conditions de microgravité de l’ISS.
Résultats
Résultats préliminaires
Les expériences menées sur l’ISS ont été soigneusement planifiées pour surmonter les limitations associées à l’ordre de g. Pour mener cette expérience, nous avons développé une nouvelle unité de décongélation et de culture (ETC), qui aidera à décongeler et à cultiver des embryons de souris congelés sur l’ISS sans entrer directement en contact avec les embryons. De nombreuses expériences préliminaires ont été réalisées pour modifier et améliorer l’ETC; ainsi, avant de réaliser une expérience spatiale, nous avons pensé qu’il pourrait être utilisé dans toutes les situations imaginables dans l’espace. Par example, en microgravité, la convection du liquide est absente; par conséquent, l’échange du cryoprotecteur au milieu de culture dans l’ETC pourrait être infructueux. Par conséquent, nous avons secoué l’ETC au cours de l’échange de solution pour confirmer que ce processus n’affecte pas le développement embryonnaire. Sur l’ISS, l’utilisation de toxines, dont 4% de paraformaldéhyde (PFA) (un agent de fixation chimique commun), est restreinte. Par conséquent, nous avons étudié si la PFA à 0,99%, qui peut être utilisée sur l’ISS, pouvait être utilisée pour la fixation des blastocystes. Après 0,99 % de fixation de l’AFP, les blastocystes seraient réfrigérés pendant environ un mois avant de retourner sur Terre. Nous avons découvert que la morphologie de ces blastocystes n’était pas affectée par le test de chute du deuxième étage, qui simule l’atterrissage au sol, et l’analyse de l’immuno-colavation / l’expression des gènes est possible pour ces blastocystes. En outre, quatre personnels de laboratoire non entraînés ont effectué l’ensemble de l’expérience simulant les conditions à l’ISS et ont obtenu de nombreux blastocystes. Ainsi, des expériences spatiales peuvent être menées sur l’ISS en utilisant les ETC et notre protocole.
Lancement d’embryons congelés et expérimentation à l’ISS
Notre projet s’intitule « Space Embryo ». Nous avons préparé des embryons congelés sur le sol pour mener l’expérience ISS. Nous avons proposé de lancer huit ETC, contenant 90 embryons de souris à deux piles surgelées/ETC, sur l’ISS. Les astronautes décongelaient les embryons de huit ETS en continu. Quatre ETC seraient incubées en g et les quatre autres dans des conditions artificielles-1 g (créées en faisant tourner les échantillons à l’intérieur d’un incubateur) pendant 4 jours. Simultanément, quatre ETC, conservés au centre spatial de Tsukuba, au Japon, sur Terre, seraient décongelés au contrôle du gaz au sol-1.
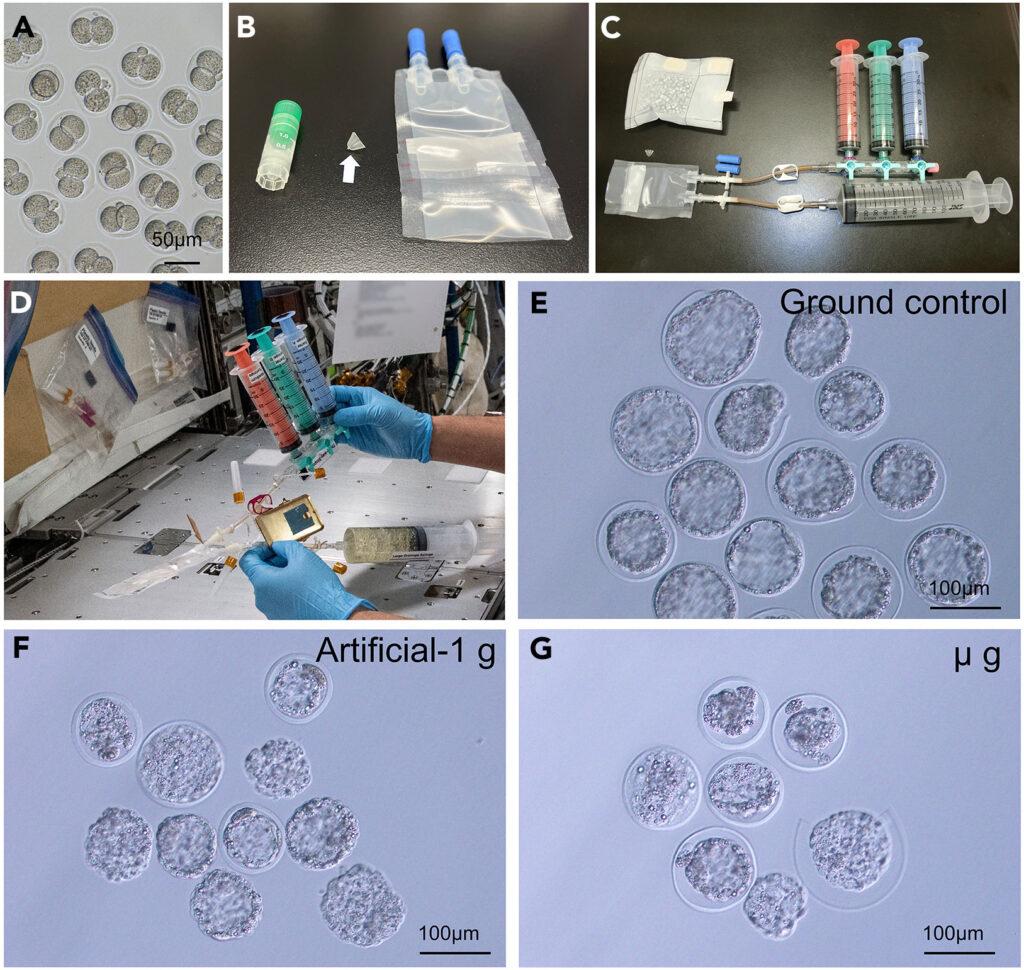
Procédure à suivre par un astronaute pour la fécondation des embryons sur l’ISS.
Trois seringues sont fixées à l’ETC dans la poche de refroidissement à l’aide d’une robinet à trois voies. La seringue bleue contient une solution de décongélation, une seringue verte contient une solution de lavage et la seringue rose contient le milieu de culture. Après avoir fixé la seringue pour le liquide de déchet, retirez l’ETC de la poche de refroidissement. Ensuite, retirez l’air à l’intérieur de l’ETC et poussez lentement la seringue bleue pour injecter la solution de décongélation dans la poche. Agiter l’ETC d’un côté à l’autre pour mélanger la solution à l’intérieur. Après avoir échangé toutes les solutions de cette manière, les embryons de l’ETC sont cultivés sur l’ISS pendant 4 jours.
Dose de rayonnement spatial.
La dose de rayonnement reçue par les embryons au cours de l’expérience a été mesurée avec un dosimètre biologique « PADLES » placé dans une boîte contenant l’échantillon. L’exposition moyenne au rayonnement spatial pendant le séjour total sur l’ISS était de 0,33 mGy (0,55 mSv) par jour. Après le lancement des ETC avec des embryons congelés à l’ISS, ils ont été conservés pendant 9 jours au congélateur avant le début des expériences. Les embryons ont été décongelés et cultivés pendant 4 jours. Par conséquent, le temps d’exposition total des embryons au rayonnement spatial était de 13 jours, et la dose totale à laquelle les embryons ont été exposés était de 4,29 mGy (7,15 mSv) à la fin de l’expérience. Les effets du rayonnement spatial pendant la cryoconservation (9 jours) et la culture des embryons vivants (4 jours) peuvent être différents sur le développement de l’embryon, mais nous n’avons pas été en mesure de l’examiner séparément.
Développement d’embryons sous microgravité sur l’ISS.
Première différenciation cellulaire.
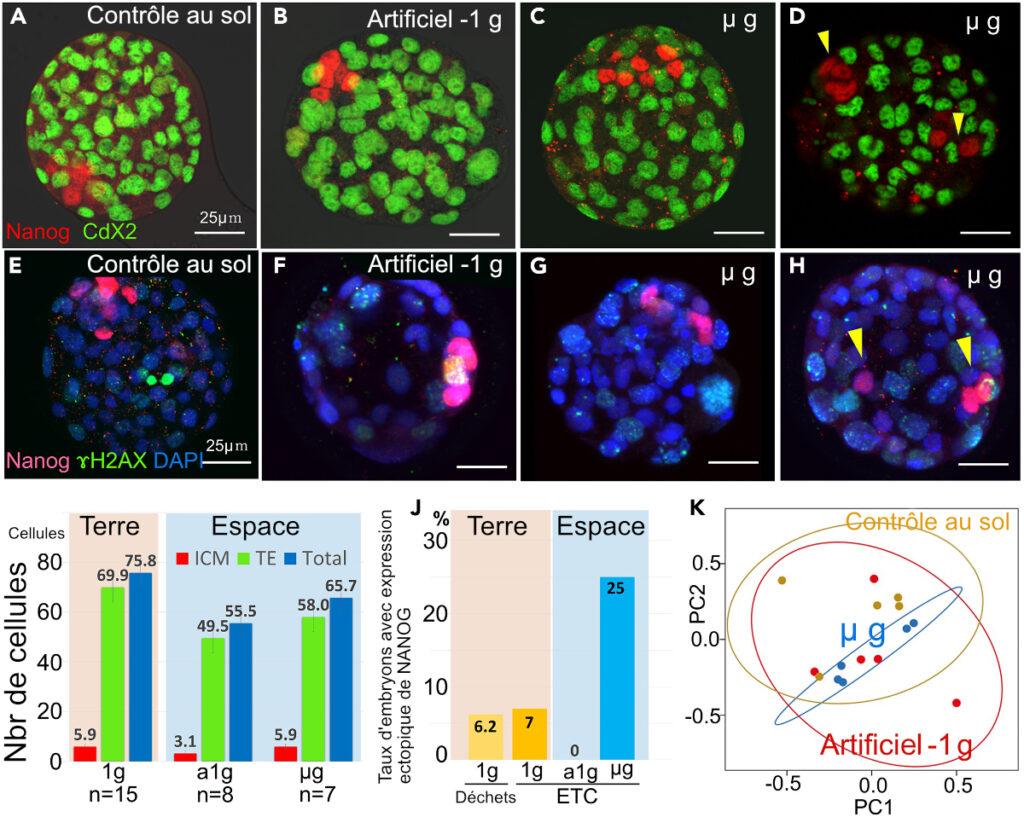
Il est intéressant de noter que l’un des sept blastocystes examinés dans le cadre de l’expérience z g a montré des blastomères avec l’expression ectopique de NANOG dans la cavité blastocyste (Figure 3 D), alors qu’aucune activité de ce type n’a été observée chez les blastocystes dans des conditions artificielles-1 g.
Légions de l’ADN dans le blastocyste
L’immunodation pour les cellules de l’ADN dans la cavité du blast2A.x et de Nanog a été réalisée pour examiner les dommages causés par l’ADN dans les cellules et la localisation des cellules de l’ICM dans la cavité blastocyste. Les cellules avec un minimum d’un foyer z-H2A.x ont été étiquetées des cellules à z-H2A.x-positif. Aucune différence dans le nombre de cellules à base de H2A.x.x positif n’a été constatée entre l’expérience de sol-1 g (4%) et de l’expérience de z-bfast (46%) (Figures 3 E-3H ; Tableau S17). Bien que moins de blastocystes aient été examinés, nous avons conclu que la microgravité et le rayonnement spatial ne causent pas de dommages à l’ADN chez les blastocystes. En revanche, le nombre de cellules de la z-H2A.x-positive a été réduit dans l’expérience artificielle-1 g par rapport aux autres; cependant, seuls quatre blastocystes ont été examinés. Notamment, deux des cinq blastocystes cultivés en p. ont montré des blastomères avec une expression ectopique de NANOG (Figure 3 H).
Blastokystes avec expression ectopique de NANOG
Au total, nous avons découvert que trois des 12 blastocystes (25%) avaient des blastomères avec une expression ectopique de NANOG dans l’expérience de microgravité sur l’ISS (Figures 3D, 3H, S18 et S19). Nous avons réalisé deux expériences supplémentaires au sol-1 g pour déterminer si c’était parce que les embryons étaient congelés en utilisant des ETC. Nous examinons 157 blastocystes obtenus par décongélation, culture, fixation et lavage d’embryons à partir de quatre ETC et trouvé 11 (7,4 %) blastocystes avec expression ectopique de cellules NANOG. Ceci est comparable aux témoins cultivés en chevelure (9/144 blastocystes, 6,2%). Ainsi, l’utilisation de ETC pour la culture n’a pas affecté la formation de grappes de la cellule ICM (Figure 3 J; Tableau S18).
Probabilité de présence de cellules ICM au fond du blastocyste
Pour déterminer la possibilité que les cellules ICM se soient rassemblées au fond de la cavité de blastocyste en raison de la gravité, nous avons examiné si les cellules ICM sont situées aux positions supérieure, moyenne ou inférieure dans la cavité des blastocystes intacts. Nous avons sélectionné 10 blastocystes expansés et non éclos et les ont laissé tomber du haut du milieu sur la coupelle. Après que tous les blastocystes avaient coulé et attaché au fond de la cuvette, l’emplacement des cellules ICM a été examiné à l’aide d’un microscope inversé; ce processus a été répété 10 fois. Bien que la localisation des cellules ICM avant la chute du blastocyste n’ait pas été observée, on suppose que la localisation des cellules ICM au moment de la chute de la pipette était aléatoire parce que le blastocyste entrait dans la pipette en rotation. Dans 89 % des blastocystes, les cellules ICM étaient situées en bas, tandis que dans les 11 cellules restantes (11 %), les cellules ICM étaient situées au milieu. Aucune des cellules de la MCI n’a été localisée sur la face supérieure du blastocyste (Tableau S19). Ainsi, les cellules ICM se localisent au fond du blastocyste éventuellement en raison de la gravité.
Analyse du séquençage de la prochaine génération
Enfin, pour détecter les différences entre les blastocystes dérivés de la masse-1 g, artificial-1 g, et de g, nous avons analysé le profil d’expression génique globale des blastocystes (Figure S20) en utilisant l’analyse du séquençage de l’ARN (ARN-seq). Des blastocystes relativement bien développés ont été sélectionnés, l’ARN a été extrait individuellement à partir de blastocyste unique, et l’ARN-seq a été réalisé. Tous les blastocystes ont montré des lectures qui étaient probablement dérivées d’acides nucléiques d’origine bactérienne, suggérant une contamination bactérienne. Il y a eu des variations dans la cartographie du génome de souris vers la séquence de référence parmi les échantillons analysés, confirmant la contamination. Le développement des blastocystes étant favorable, les données ARN-seq pour les trois groupes ont été comparées à la recherche de différences dans l’expression des gènes. Il y avait 13 gènes qui étaient exprimés de manière différentielle dans l’expérience de z g par rapport à l’expérience de zg par rapport au sol-1 g et/ou artificiel-1 g (Tableau S20). Cependant, ces gènes n’étaient pas une différence significative et étaient soit surexprimés, soit non exprimés par rapport aux témoins sol et artificiel-1g, qui n’indiquent aucune tendance commune (Figure S21). La comparaison à l’aide d’une analyse de la composantte principale (figure 3 K) a montré que les embryons artificiels-1 g (points rouges) et de marps broyés-1 g (points marrons) semblaient présenter une variation plus importante que les embryons de g (points bleus) et que les embryons broyés-1 g et plus . Cependant, l’ellipse de prouvabilité des trois groupes se chevauche dans l’ensemble, et aucune différence apparente n’a été observée.
Développement d’embryons dans des conditions de microgravité simulées sur le sol
Une expérience de microgravité simulée (artificial-z g) a également été menée à l’aide d’un clinostat 3D au sol pour comparer ses résultats avec ceux de l’expérience spatiale (Figure S22). Lorsque des embryons de stade à 2 cellules ont été congelés, décongelés et cultivés pendant 4 jours, similaires à l’expérience de l’ISS, le taux de développement du stade du blastocyste s’est avéré être de 67,1 % dans l’expérience artificielle, ce qui était significativement inférieur à celui des embryons cultivés sous contrôle 1 g sans utiliser de clinostat (82,4 %) (tableau S21). De même, lorsque des expériences ont été menées à l’aide d’embryons frais à 2 cellules non congelés, les embryons ont atteint le stade blastocyste en 3 jours, montrant un taux de développement élevé même dans des conditions artificielles – g (90,9%), qui était comparable à la croissance d’embryons cultivés dans des conditions de contrôle de 1 g (100%) (Tableau S21). Il n’y avait pas de différence dans le nombre de cellules ICM observées entre les conditions de 1 g et de l’insecte artificiel (7,2 cellules et 6,8 cellules, respectivement), mais le nombre de cellules TE était légèrement inférieur dans les g artificiels (40,1 cellules) que dans les conditions 1 g (44,4 cellules) (Tableau S22). Cependant, lorsque des expériences ont été menées à l’aide d’embryons frais et non congelés de 2 cellules, il y avait peu de différences entre les conditions 1 g et les conditions de 1 g et de g artificiels en ce qui concerne le nombre de cellules ICM et TE (Tableau S22). L’expression ectopique de NANOG dans les blastomères a été observée à la fois dans les blastocystes de 1 g (6,8 %) et de 2,7 % de culture.
Débat
Limites de l’étude
Emmanuel Chartier
Annonces PARTENAIRES
Centre de formation CFA - Certifié Qualiopi Diplômes RNCP et certifications RS.
3axes academy : Formation, Innovation, Excellence
VOIR NOS FORMATIONSOffrez-vous cette emplacement publicitaire