La véritable histoire des médicaments contre l’obésité
Bien que l’utilisation d’Ozempic pour la perte de poids soit largement médiatisée, ce n’est pas le premier médicament à susciter l’enthousiasme en tant que solution miracle pour aider à maigrir. Le GLP-1, une hormone qui a révolutionné le traitement du diabète de type 2, pourrait également jouer un rôle crucial dans la lutte contre l’obésité.
La création de traitements comme l’Ozempic et le Wegovy résulte de près de 40 ans de recherche, notamment par des scientifiques tels que M. Drucker, Joël Habener et Jens Juul Holst. Le processus, explique l’endocrinologue Daniel Drucker, a débuté il y a plus de 20 ans avec la découverte de l’hormone GLP-1, qui a depuis ouvert la voie à une nouvelle génération de médicaments favorisant la perte de poids. Les agonistes du GLP-1 administrés par injection hebdomadaire ont montré des résultats impressionnants, permettant une perte de poids d’au moins 10 % du poids initial, avec des effets secondaires généralement moins sévères. Malgré les défis rencontrés lors du développement de ces molécules, leur efficacité est indéniable selon le Dr Sean Wharton, spécialiste en médecine interne.
De longues recherches pour aboutir sur meilleur des traitement
Le Dr David Lau, endocrinologue émérite et fondateur d’Obésité Canada, souligne la nécessité de la prudence lorsqu’on aborde les percées scientifiques, y compris dans le domaine de la perte de poids. Malgré les nombreuses tentatives et une longue liste de médicaments présentés comme des solutions miracles, l’obésité reste un problème complexe de santé. Les chercheurs continuent de lutter pour comprendre les mécanismes biologiques sous-jacents qui contribuent à la difficulté de certaines personnes à perdre du poids.

Le Dr David D’Alessio, chef du Département d’endocrinologie à l’Université Duke, se souvient des nombreux médicaments qui ont été commercialisés comme des solutions révolutionnaires pour la gestion de l’obésité, mais qui ont finalement été retirés du marché en raison de leurs effets secondaires.
Par exemple, les amphétamines (phentermine) étaient largement prescrites pour perdre du poids jusqu’en 1979, mais elles sont également associées à des risques de dépendance et à des effets secondaires graves tels qu’une accélération du rythme cardiaque, une hypertension et une hyperthermie.

Pour améliorer l’efficacité des amphétamines dans la perte de poids et réduire les effets secondaires, une combinaison de médicaments a été proposée, comprenant des diurétiques, des laxatifs, des hormones thyroïdiennes, des benzodiazépines, des barbituriques, du potassium, des corticostéroïdes et des antidépresseurs. Cette association, surnommée les « pilules arc-en-ciel », a entraîné des décès, ce qui a conduit la FDA à intervenir.
Un autre médicament, l’Aminorex, un coupe-faim similaire aux amphétamines, a été retiré du marché en 1972 après une épidémie d’hypertension pulmonaire en Europe.
Dans les années 1980, le fen-phen était également considéré comme une révolution dans le traitement de l’obésité. Bien qu’il n’ait jamais été approuvé pour cette indication, il a été prescrit à plus de 18 millions de personnes sur la base d’une étude portant sur seulement 121 patients.
En 1997, le fen-phen a été retiré du marché en raison des risques accrus d’hypertension pulmonaire et de problèmes cardiovasculaires. La société Wyeth a été contrainte de verser plus de 13 milliards de dollars d’indemnisation à près de 200 000 personnes pour préjudices corporels.

Après cet échec, il faudra presque dix ans avant que la FDA n’approuve de nouveaux médicaments contre l’obésité. Parmi ceux-ci figurent Qsymia, Belviq et Contrave. Initialement rejetés par la FDA en raison d’un manque de données à long terme, ces trois médicaments ont finalement été autorisés aux États-Unis lorsque les compagnies pharmaceutiques ont fourni davantage de preuves de leur sécurité.
Le lorcasérine (Belviq) était considéré comme le médicament miracle pour la perte de poids. Cependant, en 2020, le Belviq a été retiré du marché américain en raison d’un risque accru de cancer. Au Canada et en Europe, seul le Contrave a été autorisé en raison de préoccupations concernant des problèmes cardiovasculaires, des malformations congénitales (dans le cas du Qsymia), une dépendance accrue (dans le cas du Contrave), ainsi que des tumeurs, des troubles cardiaques et des problèmes de santé mentale (dans le cas du Belviq).

L’histoire du rimonabant (Acomplia) est également significative. Ce médicament a été brièvement approuvé en Europe en 2006 mais a été retiré du marché en 2011 en raison d’un risque accru de troubles psychiatriques, notamment de dépression et de risque suicidaire, qui était deux fois plus élevé. La FDA avait également refusé son autorisation de commercialisation aux États-Unis pour ces raisons.
Dans le passé, de nombreuses approches thérapeutiques étaient explorées dans l’espoir de trouver une solution, sans une compréhension approfondie de la biologie et de la pathophysiologie de la maladie. Cependant, avec les progrès de la recherche, une meilleure compréhension de la maladie a émergé, permettant le développement de médicaments basés sur des données scientifiques solides, comme l’explique le Dr Wharton.
Après 30 ans d’utilisation, la leptine fait place au GLP-1
Dans les années 1990, la recherche sur la leptine suscitait un grand intérêt. Le généticien moléculaire Jeffrey Friedman a découvert en 1994 qu’une mutation génétique affectant la leptine, une hormone peptidique digestive induisant la satiété, était présente chez des souris obèses. L’administration de suppléments de leptine à ces souris a réduit leur appétit et leur poids. Cependant, les molécules basées sur la leptine ont montré des effets minimes sur la perte de poids et ont entraîné de nombreux effets secondaires.
Parallèlement, la recherche sur une autre hormone a conduit aux succès actuels. Plus de dix ans avant la découverte de la leptine, des chercheurs, dont MM. Holst, Habener et Drucker, se penchaient sur la recherche sur le diabète de type 2 et ont découvert l’hormone intestinale appelée GLP-1 (glucagon-like peptide 1) et ont démontré son impact sur le taux de glucose. Le GLP-1 a été identifié comme ayant un effet bénéfique sur le contrôle du diabète de type 2 en augmentant la production d’insuline et en réduisant la glycémie. Ces caractéristiques en font une cible prometteuse pour le traitement de l’obésité, explique le Dr Habener, co-découvreur et qui a caractérisé le GLP-1.
Le Dr David Lau ajoute que le GLP-1 est l’une des nombreuses hormones impliquées dans la régulation de l’appétit, de l’insuline et du métabolisme du glucose. Les analogues du GLP-1, conçus initialement pour traiter le diabète de type 2, agissent en réduisant la libération de glucagon et en stimulant la production d’insuline, sans induire d’hyperglycémie.

Le Dr David Drucker, qui a intégré l’équipe du Dr Habener après la découverte initiale, n’aurait jamais anticipé que leurs travaux aboutiraient au développement de médicaments pour traiter le diabète de type 2, et encore moins pour l’obésité. « J’étais alors au début de ma carrière scientifique, et mon mentor était extrêmement enthousiaste quant à la portée de notre découverte », se remémore ce chercheur torontois.
Cependant, leurs avancées initiales ont été accueillies avec scepticisme, comme l’explique le Dr D’Alessio. En effet, lors des conférences sur le GLP-1 tenues par le Dr Drucker dans les années 1980 et 1990, l’audience était clairsemée. « Ce domaine de recherche n’attirait guère l’attention à l’époque », ajoute-t-il. En reconnaissance de leurs années de recherche, ce trio a été honoré du prestigieux prix Gairdner en 2021, une distinction qui célèbre les avancées médicales majeures à l’échelle mondiale.
Manque de reconnaissance pour le travail de Svetlana Mojsov

D’autres chercheurs ont également contribué de manière significative à la compréhension de l’hormone GLP-1. La scientifique et doctoresse Svetlana Mojsov, une chimiste, a joué un rôle crucial dans sa découverte, selon le magazine Science. Malgré cela, elle a dû lutter pendant des décennies pour obtenir la reconnaissance de son travail, au même titre que les Dr Drucker, Holst et Habener. Comme le Dr Habener, elle travaillait au Massachusetts General Hospital dans les années 1980 et a publié l’un des premiers articles influents sur le GLP-1. Récemment, des revues scientifiques comme Nature et Cell ont publié des corrections pour avoir omis de mentionner le travail de la scientifique Svetlana Mojsov dans leurs publications.
Une des raisons qui expliquent le délai de près de 20 ans avant que leurs travaux en laboratoire aboutissent à des médicaments réside dans la dégradation rapide du GLP-1 par l’enzyme dipeptidyl peptidase-4 dans l’intestin, entravant ainsi tout développement de médicaments.
En 1995, le Dr Daniel Drucker a eu l’idée d’explorer le venin du monstre de Gila, un reptile capable de supporter de longues périodes sans nourriture en ralentissant son métabolisme. Il était déjà connu que des hormones contenues dans le venin de ce reptile régulaient la glycémie, c’est-à-dire le taux de sucre dans le sang.
Les recherches du Dr Drucker et de son équipe ont révélé la présence d’Exendin-4 dans le venin du monstre de Gila, une protéine structurellement similaire à l’hormone humaine GLP-1. Il s’est avéré que l’Exendin-4 restait actif dans le corps plus longtemps que le GLP-1.
Par la suite, l’hormone du monstre de Gila a été synthétisée par le biochimiste américain Dr John Eng. Le médicament utilisant cette molécule, appelé Exénatide, a été approuvé par la FDA en 2005 pour le traitement du diabète de type 2, puis par Santé Canada en 2007.
Le Dr D’Alessio souligne la particularité de ces nouveaux agonistes, qui ont une durée d’action prolongée et permettent une plus grande perte de poids.
Plusieurs version basés sur les incrétines
Ce premier agoniste du GLP-1 a ouvert la voie à plusieurs autres développements dans le domaine. Selon le Dr Habener, il aurait rétrospectivement envisagé que les médicaments testés pour le diabète pourraient également être bénéfiques pour la perte de poids.
Lors des premiers essais cliniques pour traiter le diabète, les participants ont signalé une réduction de l’appétit. Cependant, des effets indésirables tels que des vomissements et des troubles gastro-intestinaux ont nécessité une réduction de la dose, suscitant l’intérêt des compagnies pharmaceutiques pour cet effet secondaire inattendu.
Les incrétines, hormones gastro-intestinales qui stimulent la sécrétion d’insuline en réponse à une hyperglycémie, sont ainsi passées d’un domaine de recherche obscur à un domaine d’étude soutenu financièrement par les grandes compagnies pharmaceutiques.
En 2014, le liraglutide (Saxenda) est devenu le premier agoniste du GLP-1 autorisé pour la perte de poids, montrant une capacité à induire une perte de poids corporel moyenne d’environ 8 %, soit 5 % de plus que chez les personnes prenant un placebo. Cependant, outre les problèmes gastro-intestinaux fréquemment rapportés, ce médicament a également été associé à un risque accru de cancer de la thyroïde ou de pancréatite.
Bien que toujours autorisé et utilisé, les compagnies pharmaceutiques recherchent activement des alternatives plus efficaces avec moins d’effets secondaires. Les ajustements de dosage et les développements de médicaments ultérieurs ont permis d’améliorer l’efficacité tout en réduisant les effets indésirables des agents pharmacologiques développés dans les années 1990 et au début des années 2000, tels que le bupropion-naltrexone (Contrave), l’orlistat (Xenical, Alli) ou le phentermine-topiramate (Qsymia).
Le sémaglutide, une dérivée modifiée du liraglutide, a démontré une efficacité surprenante qui a rompu avec les tendances antérieures. Dans une étude regroupant près de 2000 participants, ceux traités au sémaglutide ont présenté une perte de poids moyenne de 14,9 % de leur poids initial sur une période de 16 mois, par rapport à seulement 2,4 % pour le groupe placebo.
La durée d’action prolongée du sémaglutide dans l’organisme contribue à stabiliser le taux de glucose chez les patients. En 2017, la FDA a approuvé l’utilisation du sémaglutide sous le nom d’Ozempic pour le traitement du diabète de type 2. Quatre ans plus tard, le Wegovy, une version à dose plus élevée d’Ozempic, a également été approuvé pour le traitement de la perte de poids.

Actuellement, le sémaglutide figure parmi les cinq médicaments approuvés pour le traitement de l’obésité.
- Bupropion-naltrexone (Contrave)
- Liraglutide (Saxenda)
- Orlistat (Xenical, Alli)
- Semaglutide (Wegovy)
- Setmelanotide (Imcivree)
Comme souvent en science, ce processus est un cheminement progressif, caractérisé par des découvertes en science fondamentale, leur validation en laboratoire et sur des modèles animaux, puis enfin leur évaluation chez l’homme, avec des avancées et des revers. Ce n’est donc pas un succès instantané, souligne le Dr. Drucker. Cependant, il est gratifiant de constater que nos recherches peuvent contribuer à améliorer la santé des individus.
Quels sont les traitements de remplacement disponibles pour le GLP-1 ?

Les sociétés pharmaceutiques poursuivent leurs efforts pour développer des médicaments plus efficaces que le sémaglutide. Les chercheurs s’attachent désormais à identifier les molécules ayant le plus d’impact tout en produisant moins d’effets secondaires, en particulier les effets gastriques souvent signalés. La découverte du GLP-1 a incité les chercheurs à explorer l’effet d’autres hormones incrétines sur les comportements alimentaires. On s’interroge sur le nombre d’hormones impliquées dans le mécanisme de l’appétit et sur leurs liens éventuels. Parmi ces hormones, la ghréline, considérée comme l’agoniste inverse de la leptine, suscite un intérêt particulier. Un vaccin anti-obésité ciblant spécifiquement la ghréline est en cours d’essai, visant à diminuer l’appétit et le poids en empêchant la ghréline d’atteindre le système nerveux central. Les recherches se concentrent également sur le concept de co-agonisme, activant simultanément les récepteurs de deux hormones. Par exemple, le tirzépatide (Mounjaro) agit sur les récepteurs du GLP-1 et du GIP, entraînant une importante perte de poids similaire à la chirurgie bariatrique. Cependant, le rôle du GIP dans la perte de poids reste peu clair malgré les résultats prometteurs du tirzépatide. Des essais cliniques sur des composés triples agonistes, tels que le retatrutide, qui imite trois hormones (GLP-1, GIP et glucagon), ont montré des résultats encourageants en termes de perte de poids avec des effets secondaires tolérables. Cependant, certains essais cliniques sur d’autres composés, comme la molécule NN1177 de Novo Nordisk, ont été interrompus en raison d’effets secondaires indésirables, soulignant les défis persistants dans le développement de médicaments pour la gestion du poids et de l’obésité.
Définition :
Agonistes
Les agonistes sont des molécules qui miment l’action de l’hormone humaine. Un double agoniste est une molécule qui imitent deux hormones humaines.
Incrétines
Hormones gastro-intestinales qui stimulent la sécrétion d’insuline lorsque la glycémie est trop élevée
GLP-1
(en anglais : glucagon-like peptide 1) réduit la glycémie en stimulant la sécrétion d’insuline et en réduisant la sécrétion de glucagon lorsque la glycémie est élevée lorsqu’on mange. Ce mécanisme retarde la vidange de l’estomac et augmente l’impression de satiété. Lors d’une hypoglycémie, le GLP-1 diminue la sécrétion d’insuline sans altérer la sécrétion du glucagon.
GIP
Une hormone gastro-intestinale connue sous le nom peptide insulinotrope dépendant du glucose (en anglais, gastric inhibitory polypeptide ou GIP).
Leptine
Une hormone digestive peptidique qui induit une sensation de satiété. Donner des suppléments de leptine à des souris obèses qui ont un manque de cette hormone réduit leur appétit et leur poids.
Ghréline
Il s’agit de la première hormone de régulation de l’appétit à être découverte. Elle est considérée comme l’agoniste inverse de la leptine.
Liraglutide
Il s’agit du premier agoniste du GLP-1 autorisé pour la perte de poids. Nom commercial: Saxenda
Sémaglutide
Cette molécule est une version modifiée de la molécule liraglutide (un agoniste du GLP-1). Le sémaglutide reste actif dans l’organisme plus longtemps que les molécules précédentes, aidant à stabiliser le glucose des patients. Nom commercial : Ozempic, Wegovy, Rybelsus
Retatrutide
Ce triple agoniste imite trois hormones : le GLP-1, le GIP et le glucagon. Cette molécule est en développement et n’a pas été autorisée, ni commercialisée.
Le GLP-1, le couteau suisse des hormones
Des données de plus en plus nombreuses suggèrent que les agonistes du GLP-1 exercent un impact multifactoriel touchant divers organes, notamment le cerveau, le pancréas, le système cardiovasculaire et le système gastro-intestinal. Ces molécules semblent ainsi présenter un potentiel d’application varié et étendu.
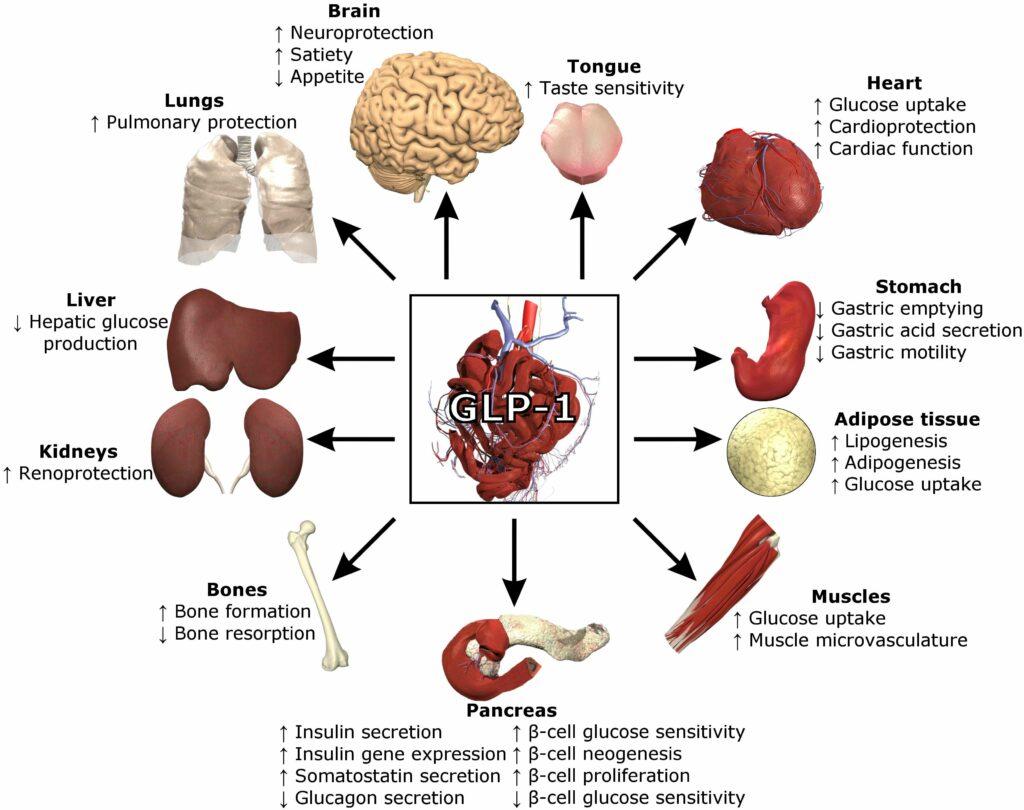
Des récepteurs du GLP-1 ont été identifiés dans divers tissus anatomiques, notamment le cerveau, les reins, le cœur et plusieurs autres organes, suggérant ainsi une importance multifactorielle. Cette distribution étendue des récepteurs du GLP-1 suscite un vif intérêt chez les chercheurs, qui explorent les multiples voies d’action associées à cette hormone polyvalente.
Le GLP-1, souvent qualifié de « couteau suisse » des hormones en raison de ses multiples fonctions, exerce des effets divers sur des domaines variés tels que le diabète, le poids corporel, les maladies cardiovasculaires, et il est même envisagé comme ayant un impact potentiel sur des pathologies comme la maladie d’Alzheimer ou sur le foie. Les mécanismes d’action du GLP-1 sont actuellement l’objet d’une investigation approfondie pour mieux comprendre ses implications dans ces divers processus physiologiques.
De récentes données préliminaires publiées par la compagnie Novo Nordisk suggèrent que les agonistes du GLP-1 pourraient réduire de manière significative les risques de maladies cardiovasculaires, offrant ainsi des perspectives prometteuses. Des hypothèses sont également formulées quant à la capacité de ces molécules à ralentir la progression de la démence, à traiter la dépendance et le syndrome des ovaires polykystiques.
Cependant, le Dr D’Alessio et M. Drucker soulignent la nécessité d’une prudence quant aux conclusions hâtives, rappelant que la validation de ces hypothèses nécessitera encore de nombreuses années de recherche approfondie. Ils envisagent néanmoins un avenir où les agonistes du GLP-1 pourraient étendre leurs applications au-delà du diabète et de l’obésité, pour potentiellement traiter des conditions telles que la maladie d’Alzheimer, la maladie de Parkinson et les affections hépatiques métaboliques.
Annonces PARTENAIRES
Centre de formation CFA - Certifié Qualiopi Diplômes RNCP et certifications RS.
3axes academy : Formation, Innovation, Excellence
VOIR NOS FORMATIONSOffrez-vous cette emplacement publicitaire








