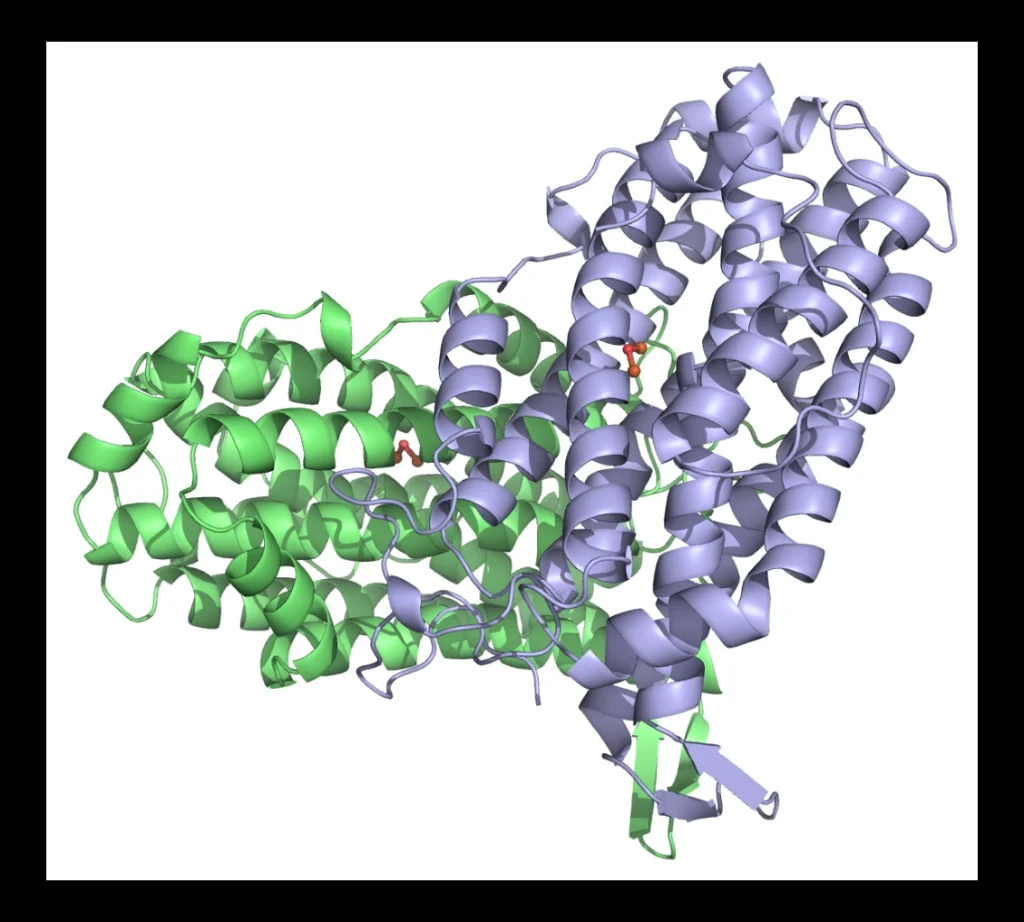
Structure d’une protéine R2 de la ribonucléotide réductase avec un radical.
L’incapacité des mutants Cys→Ala du site M(Cys)4 de la protéine α d’E. coli à générer le radical glycinyle essentiel a suggéré l’importance de ce site pour l’activité RNR. Dans la première partie de ce travail nous avons cherché à identifier le métal lié à la protéine α d’E. coli puis à comprendre de quelle manière le site M(Cys)4 participe à la formation du radical Gly• de la protéine α. Pour cela la caractérisation structurale et fonctionnelle de la protéine α sauvage et des mutants Cys→Ala du site métallique a été entreprise. L’importance du zinc pour l’intégrité structurale des polypeptides a été mise en évidence et la modification des conditions de préparation de la protéine α a permis d’obtenir des préparations possédant une activité RNR élevée. Les résultats obtenus sont en accord avec un rôle structural du site Zn(Cys)4 de la protéine α d’E. coli.
Structure d’une protéine R2 de la ribonucléotide réductase avec un radical. Read More »